I “sistemi CRISPR-Cas” nei batteri e nei virus identificano e distruggono le sequenze virali invasori. È un sistema immunitario batterico e arcaico per la protezione contro le infezioni virali. Nel 2012, il sistema CRISPR-Cas è stato riconosciuto come sistema genoma strumento di modifica. Da allora, è stata sviluppata un’ampia gamma di sistemi CRISPR-Cas che hanno trovato applicazioni in settori quali la terapia genica, la diagnostica, la ricerca e il miglioramento delle colture. Tuttavia, i sistemi CRISPR-Cas attualmente disponibili hanno un uso clinico limitato a causa dei frequenti casi di editing fuori bersaglio, mutazioni inattese del DNA e problemi ereditari. I ricercatori hanno recentemente segnalato un nuovo sistema CRISPR-Cas che può prendere di mira e distruggere l'mRNA e proteine associati a diverse malattie genetiche in modo più accurato senza impatti fuori bersaglio e problemi ereditari. Chiamato Craspase, è il primo sistema CRISPR-Cas che mostra le proteine funzione di modifica. È anche il primo sistema in grado di modificare sia RNA che le proteine. Poiché Craspase supera molte limitazioni dei sistemi CRISPR-Cas esistenti, ha il potenziale per rivoluzionare la terapia genica, la diagnostica e il monitoraggio, la ricerca biomedica e il miglioramento delle colture.
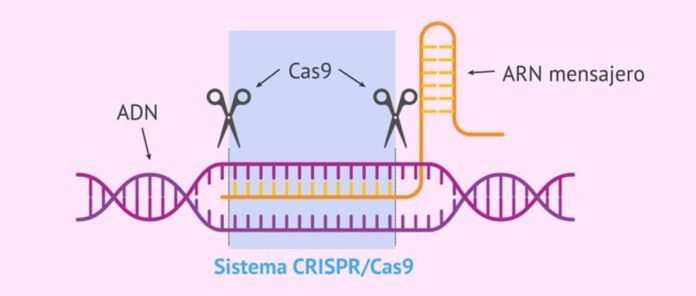
Il “sistema CRISPR-Cas” è il sistema immunitario naturale di batteri e archaea contro le infezioni virali che identifica, lega e degrada le sequenze del gene virale da proteggere. È costituito da due parti: l'RNA batterico trascritto dal gene virale incorporato nel genoma batterico dopo la prima infezione (chiamato CRISPR, questo identifica le sequenze bersaglio dei geni virali invasori) e un distruttore associato le proteine denominato “associato a CRISPR”. le proteine (Cas)” che lega e degrada le sequenze identificate nel gene virale per proteggere i batteri dai virus.
FRITTO sta per “brevi ripetizioni palindromiche raggruppate regolarmente interspaziate”. Si tratta di RNA batterico trascritto caratterizzato da ripetizioni palindromiche.
Le ripetizioni palindromiche (CRISPR) furono scoperte per la prima volta nelle sequenze di E. coli nel 1987. Nel 1995, Francisco Mojica osservò strutture simili negli archaea, e fu lui il primo a pensarle come parte del sistema immunitario di batteri e archaea. Nel 2008 è stato dimostrato sperimentalmente per la prima volta che il bersaglio del sistema immunitario di batteri e archaea era il DNA estraneo e non l'mRNA. Il meccanismo di identificazione e degradazione delle sequenze virali ha suggerito che tali sistemi potrebbero essere utilizzati come strumento per modifica del genoma. Dal suo riconoscimento come strumento di editing genomico nel 2012, il sistema CRISPR-Cas ha fatto molta strada diventando uno standard saldamente consolidato editing gene sistema e ha trovato un'ampia gamma di applicazioni nella biomedicina, nell'agricoltura, nell'industria farmaceutica, inclusa la terapia genica clinica1,2.
Una vasta gamma di CRISPR-I sistemi Cas sono già identificati e attualmente disponibili per il monitoraggio e la modifica di sequenze di DNA/RNA per la ricerca, lo screening farmacologico, la diagnostica e i trattamenti. Gli attuali sistemi CRISPR/Cas sono suddivisi in 2 classi (Classe 1 e 2) e sei tipi (Tipo da I a XI). I sistemi di Classe 1 hanno più Cas proteine che devono formare un complesso funzionale per legarsi e agire sui loro obiettivi. D'altra parte, i sistemi di Classe 2 hanno un solo Cas di grandi dimensioni le proteine per legare e degradare le sequenze target che rendono i sistemi di Classe 2 più facili da usare. I sistemi di Classe 2 comunemente utilizzati sono Cas 9 Tipo II, Cas13 Tipo VI e Cas12 Tipo V. Questi sistemi possono avere effetti collaterali indesiderati, ad esempio impatto fuori bersaglio e citotossicità3,5.
Terapie geniche basati sugli attuali sistemi CRISPR-Cas hanno un uso clinico limitato a causa dei frequenti casi di modifica fuori bersaglio, mutazioni inaspettate del DNA, comprese grandi delezioni di frammenti di DNA e grandi varianti strutturali del DNA sia nei siti target che fuori target che portano alla morte cellulare e altri problemi ereditari.
Craspasi (o caspasi guidata da CRISPR)
I ricercatori hanno recentemente segnalato un nuovo sistema CRISPER-Cas che è un sistema Cas2-7 di Classe 11 Tipo III-E associato a un sistema simile alla caspasi le proteine quindi nominato Craspase o caspasi guidata da CRISPR 5 (Le caspasi sono proteasi della cisteina che svolgono un ruolo chiave nell'apoptosi nella disgregazione delle strutture cellulari). Ha potenziali applicazioni in settori come la terapia genica e la diagnostica. La craspasi è guidata e mirata all'RNA e non viene coinvolta nelle sequenze di DNA. Può prendere di mira e distruggere l'mRNA e proteine associati a diverse malattie genetiche in modo più accurato senza impatti fuori bersaglio. Pertanto, l'eliminazione dei geni associati alle malattie è possibile mediante scissione a livello di mRNA o proteine. Inoltre, se collegata ad un enzima specifico, la craspasi può essere utilizzata anche per modificare le funzioni delle proteine. Quando le sue funzioni RNasi e proteasi vengono rimosse, la Craspasi viene disattivata (dCraspasi). Non ha funzione di taglio ma si lega all'RNA e alle sequenze proteiche. Pertanto, dCraspase può essere utilizzato nella diagnostica e nell'imaging per monitorare e diagnosticare malattie o virus.
Craspase è il primo sistema CRISPR-Cas che mostra la funzione di modifica delle proteine. È anche il primo sistema in grado di modificare sia l’RNA che le proteine. Suo editing gene la funzione ha effetti minimi fuori bersaglio e nessun problema ereditabile. Pertanto, è probabile che Craspase sia più sicuro nell’uso clinico e terapeutico rispetto ad altri sistemi CRISPR-Cas attualmente disponibili 4,5.
Poiché Craspase supera molti limiti dei sistemi CRISPR-Cas esistenti, ha il potenziale per rivoluzionare la terapia genica, la diagnostica e il monitoraggio, la ricerca biomedica e il miglioramento delle colture. Sono necessarie ulteriori ricerche per sviluppare un sistema di consegna affidabile per colpire con precisione i geni che causano malattie nelle cellule prima di dimostrare la sicurezza e l'efficacia negli studi clinici.
***
Riferimenti:
- Gostimskaya, I. CRISPR-Cas9: una storia della sua scoperta e considerazioni etiche sul suo utilizzo nell'editing del genoma. Biochimica Mosca 87, 777–788 (2022). https://doi.org/10.1134/S0006297922080090
- ChaoLi et al 2022. Strumenti e risorse computazionali per l'editing del genoma CRISPR/Cas. Genomica, proteomica e bioinformatica. Disponibile online dal 24 marzo 2022. DOI: https://doi.org/10.1016/j.gpb.2022.02.006
- van Beljouw, SPB, Sanders, J., Rodríguez-Molina, A. et al. Sistemi CRISPR-Cas mirati all'RNA. Nat Rev Microbiol 21, 21–34 (2023). https://doi.org/10.1038/s41579-022-00793-y
- Chunyi Hu et al 2022. Craspase è una proteasi CRISPR RNA-guidata, RNA-attivata. Scienza. 25 agosto 2022. Vol 377, Numero 6612. pp. 1278-1285. DOI: https://doi.org/10.1126/science.add5064
- Huo, G., Shepherd, J. & Pan, X. Craspase: un nuovo editor di doppio gene CRISPR/Cas. Genomica funzionale e integrativa 23, 98 (2023). Pubblicato: 23 marzo 2023. DOI: https://doi.org/10.1007/s10142-023-01024-0
***