Gli umani non sarebbero esistiti senza virus perché la proteina virale svolge un ruolo chiave nello sviluppo dell'embrione umano. Tuttavia, a volte, rappresentano minacce esistenziali sotto forma di malattie come nel caso dell'attuale pandemia di COVID-19. Ironia della sorte, i virus comprendono circa l'8% del nostro genoma, che è stato acquisito nel corso dell'evoluzione, rendendoci "virtualmente una chimera".
La parola più famigerata e terribile dell'anno 2020 senza dubbio è 'virus'. Il romanzo Coronavirus è responsabile dell'attuale malattia COVID-19 senza precedenti e di un quasi collasso dell'economia mondiale. Tutto ciò è causato da una minuscola particella che non è nemmeno considerata "completamente" vivente perché è in uno stato non funzionale all'esterno dell'ospite, mentre si perpetua solo all'interno infettando l'ospite. Più sorprendente e scioccante è il fatto che il gli esseri umani portano i "geni" virali da tempi immemorabili e attualmente i geni virali costituiscono circa l'8% del genoma umano (1). Giusto per mettere questo in prospettiva, solo circa l'1% del genoma umano è funzionalmente attivo responsabile della produzione di proteine che determinano chi siamo.
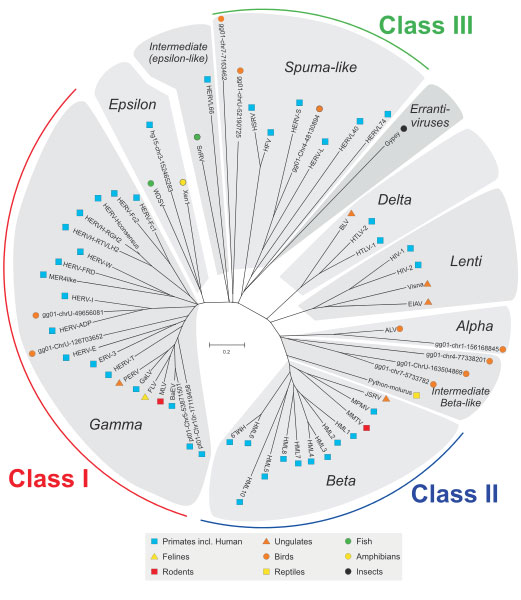
La storia del rapporto tra umani e virus iniziato 20-100 milioni di anni fa, quando i nostri antenati sono stati infettati da virus. Ogni famiglia di retrovirus endogeni deriva da una singola infezione delle cellule germinali da parte di un retrovirus esogeno che, dopo essersi integrato nel nostro antenato, si è espanso ed evoluto (2). La propagazione è seguita dal trasferimento orizzontale dai genitori alla prole e oggi abbiamo questi genomi virali incorporati nel nostro DNA come retrovirus endogeni umani (HERV). Questo è un processo continuo e potrebbe anche accadere in questo momento. Nel corso dell'evoluzione, questi HERV hanno acquisito mutazioni, si sono stabilizzati nel genoma umano e hanno perso la capacità di causare la malattia. I retrovirus endogeni non sono presenti solo nell'uomo, ma sono onnipresenti in tutti gli organismi viventi. Tutti questi retrovirus endogeni raggruppati in tre classi (Classe I, II e III) che si verificano in diverse specie animali mostrano una relazione filogenetica basata sulla loro somiglianza di sequenza (3) come illustrato nella Figura seguente. Gli HERV appartengono al gruppo di Classe I.
Dei vari retrovirus incorporati presenti nel genoma umano, un classico esempio degno di nota è quello di una proteina retrovirale che è una proteina dell'involucro altamente fusogeno chiamata sincitina, (5) la cui funzione originale nel virus era quella di fondersi con le cellule ospiti per causare infezione. Questa proteina è stata ora adattata nell'uomo per formare la placenta (fusione di cellule per creare cellule multinucleate) che non solo fornisce cibo al feto dalla madre durante la gravidanza, ma protegge anche il feto dal sistema immunitario della madre a causa della natura immunosoppressiva della sincitina proteina. Questo particolare HERV ha dimostrato di essere benefico per la razza umana definendo la sua stessa esistenza.
Gli HERV sono stati anche implicati nel fornire immunità innata all'ospite prevenendo ulteriori infezioni da virus correlati o riducendo la gravità della malattia in caso di reinfezione da parte di virus simili. Una revisione del 2016 di Katzourakis e Aswad (6) descrive che i virus endogeni possono agire come elementi regolatori per i geni che controllano la funzione immunitaria, portando così allo sviluppo dell'immunità. Nello stesso anno, Chuong et al (7) hanno dimostrato che alcuni HERV agiscono come potenziatori regolatori modulando l'espressione dei geni inducibili dall'IFN (interferone) fornendo così l'immunità innata. I prodotti di espressione di HERV possono anche agire come pattern molecolari associati ai patogeni (PAMP), attivando i recettori cellulari responsabili della prima linea di difesa dell'ospite (8-10).
Un altro aspetto interessante degli HERV è che alcuni di essi mostrano polimorfismi di inserzione, cioè diversi numeri di copie sono presenti nel genoma a causa di eventi inserzionali. Uno studio su 20 soggetti appartenenti a diversi gruppi etnici ha rivelato modelli di polimorfismo di inserzione tra 0-87% in tutti i soggetti (11). Ciò può avere implicazioni nel causare malattie mediante l'attivazione di alcuni geni che altrimenti sarebbero silenziosi.
Alcuni HERV hanno anche dimostrato di essere associati allo sviluppo di malattie autoimmuni come la sclerosi multipla (12). In condizioni fisiologiche normali, l'espressione di HERV è strettamente regolata mentre in condizioni patologiche dovute a cambiamenti nell'ambiente esterno/interno, i cambiamenti ormonali e/o l'interazione microbica possono causare una disregolazione dell'espressione di HERV, portando alla malattia.
Le suddette caratteristiche degli HERV suggeriscono che non solo la loro presenza nel genoma umano è inevitabile, ma possiedono la capacità di regolare l'omeostasi del sistema immunitario attivandolo o sopprimendolo, causando così effetti differenziali (da benefici a causare una malattia) in padroni di casa.
La pandemia di COVID-19 è causata anche da un retrovirus SARS-nCoV-2, che appartiene alla famiglia dell'influenza, e può essere plausibile che, nel corso dell'evoluzione, i genomi relativi a questa famiglia di virus siano stati integrati nel genoma umano e sono ora presenti come HERV. Si presume che questi HERV possano esibire diversi polimorfismi, come menzionato sopra, tra persone di diversa etnia. Questi polimorfismi possono essere sotto forma di numero di copie differenziale di questi HERV e/o presenza o assenza di mutazioni (cambiamenti nella sequenza del genoma) accumulate in un periodo di tempo. Questa variabilità negli HERV integrati può offrire una spiegazione per i tassi di mortalità differenziali e la gravità della malattia COVID-19 nei diversi paesi colpiti dalla pandemia.
***
Riferimenti:
1. Griffiths DJ 2001. Retrovirus endogeni nella sequenza del genoma umano. Genoma biologico. (2001); 2(6) Recensioni 1017. DOI: https://doi.org/10.1186/gb-2001-2-6-reviews1017
2. Boeke, JD; Stoye, JP (1997). "Retrotrasposoni, retrovirus endogeni e l'evoluzione dei retroelementi". Nella bara, JM; Hughes, SH; Varmus, HE (a cura di). Retrovirus. Pressa da laboratorio di Cold Spring Harbor. PMID 21433351.
3. Vargiu L, et al. Classificazione e caratterizzazione dei retrovirus endogeni umani; le forme del mosaico sono comuni. Retrovirologia (2016); 13: 7. DOI: 10.1186 / s12977-015-0232-y
4. Classes_of_ERVs.jpg: Jern P, Sperber GO, Blomberg J (opera derivata: Fgrammen (talk)), 2010. Disponibile online su https://commons.wikimedia.org/wiki/File:Classes_of_ERVs.svg Accesso effettuato il 07 maggio 2020
5. Biondo, JL; Lavillette, D; Cheynet, V; Bouton, O; Oriol, G; Chapel-Fernandes, S; Mandrande, S; Maglio, F; Cosset, FL (7 aprile 2000). "Una glicoproteina dell'involucro del retrovirus endogeno umano HERV-W è espressa nella placenta umana e fonde le cellule che esprimono il recettore del retrovirus dei mammiferi di tipo D". J. Virol. 74 (7): 3321-9. DOI: https://doi.org/10.1128/jvi.74.7.3321-3329.2000.
6. Katzourakis A e Aswad A. Evoluzione: i virus endogeni forniscono scorciatoie nell'immunità antivirale. Biologia attuale (2016). 26: R427-R429. http://dx.doi.org/10.1016/j.cub.2016.03.072
7. Chuong EB, Elde NC e Feschotte C. Evoluzione normativa dell'immunità innata attraverso la cooptazione di retrovirus endogeni. Scienza (2016) vol. 351, Numero 6277, pp. 1083-1087. DOI: https://doi.org/10.1126/science.aad5497
8. Wolff F, Leisch M, Greil R, Risch A, Pleyer L. L'arma a doppio taglio della (ri)espressione dei geni da parte di agenti ipometilanti: dal mimetismo virale allo sfruttamento come agenti di innesco per la modulazione mirata del checkpoint immunitario. Segnale di comunicazione cellulare (2017) 15:13. DOI: https://doi.org/10.1186/s12964-017-0168-z
9. Hurst TP, Magiorkinis G. Attivazione della risposta immunitaria innata da parte dei retrovirus endogeni. J Gen Virol. (2015) 96:1207-1218. DOI: https://doi.org/10.1099/vir.0.000017
10. Chiappinelli KB, Strissel PL, Desrichard A, Chan TA, Baylin SB, Corrispondenza S. L'inibizione della metilazione del DNA provoca una risposta all'interferone nel cancro tramite dsRNA inclusi i retrovirus endogeni. Cella (2015) 162: 974–986. DOI: https://doi.org/10.1016/j.cell.2015.07.011
11. Mehrab G, Sibel Y, Kaniye S, Sevgi M e Nermin G. Screening di inserimento del retrovirus-H endogeno umano. Rapporti di medicina molecolare (2013). DOI: https://doi.org/10.3892/mmr.2013.1295
12. Gröger V e Cynis H. Retrovirus endogeni umani e il loro ruolo putativo nello sviluppo di malattie autoimmuni come la sclerosi multipla. Microbiolo anteriore. (2018); 9: 265. DOI: https://doi.org/10.3389/fmicb.2018.00265
***